2 DF et 2 OS
Gravimétrie (DF/OS)
La gravimétrie est une méthode d'analyse qui utilise la masse. Elle peut permettre de trouver soit la nature d'un composé (par la quantité de l'un de ses ions), soit la quantité d'une substance dans un mélange. Le principe est de faire réagir chimiquement l'ion, l'élément ou le composé dont on veut connaître la teneur dans l'échantillon. Selon le cas, ce peut être la masse du produit ou la différence de masse de l'échantillon qui permettront de déterminer la teneur ou la nature du produit.
| Image | Le cours | Les compléments |
|---|---|---|
 |
"Le biscuit au chocolat" |
La mole (lecture) Gaz parfait (video) |
Oxydoréduction (DF/OS)
Une réaction d'oxydo-réduction est une réaction chimique au cours de laquelle se produit un transfert d'électrons. L'espèce chimique qui capte les électrons est appelé « oxydant » ; celle qui les cède, « réducteur ». Les réactions d'oxydo-réductions constituent une grande famille comprenant de nombreuses réactions chimiques, puisqu'elles interviennent dans les combustions, certains dosages métallurgiques, la corrosion des métaux, l'électrochimie ou la respiration cellulaire. Ces réactions jouent en particulier un rôle fondamental en biologie, dans la transformation de l'oxygène au sein des corps vivants.
| Le cours | Les compléments | |
|---|---|---|
 |
Piles et accumulateurs (lecture) Calculateur du nombre d'oxydation |
Concentration (DF/OS)
La concentration molaire, ou molarité, est la quantité de matière de soluté par unité de volume de solution. Son symbole est C ; cependant, la plupart du temps, quand on parle successivement de la concentration de plusieurs espèces chimiques différentes, on utilise plutôt la notation [symbole de l'espèce] (ex: [Cu2+] : concentration en ion cuivre II). Son unité usuelle est la mole par litre (mol/L) et ses sous-multiples. Elle ne peut être définie que si le milieu est homogène ; sa valeur étant identique en chaque lieu de la solution.
| Image | Le cours | Les compléments |
|---|---|---|
 |
Volumétrie (DF/OS)
| Image | Le cours | Les compléments |
|---|---|---|
 |
pH (DF)
- inférieur à 7 est acide ;
- supérieur à 7 est basique ;
- égal à 7 est neutre.
| Image | Le cours | Les compléments |
|---|---|---|
 |
Le chaulage (lecture) Courbes de titrage (visualisation et calcul du pH) |
Énergétique (OS)
Cette nature quantique limite les configurations électroniques possibles et définit l'énergie qui leur correspond. Une réaction chimique correspond à la transition d'une configuration à une autre (passage d'un niveau d'énergie à un autre).
Si le niveau d'énergie d'arrivée est plus élevé que celui de départ, il faut fournir de l'énergie. La réaction est dite endo-énergétique (l'énergie étant fournie par le milieu, la température de celui-ci diminue).
Si le niveau d'énergie d'arrivée est plus bas que celui de départ, il y a dégagement d'énergie. La réaction est dite exo-énergétique (l'énergie libérée est capturée par le milieu dont la température augmente).
Dans le cas d'une réaction nucléaire (fission ou fusion), la masse des noyaux des constituants de départ et d'arrivée est différente. Cette différence se traduit sous forme d'énergie par la célèbre relation de la relativité d'Einstein E = mc2, où E est l'énergie libérée lors de la réaction et m l'écart de masse entre l'état initial et l'état final et où "c" est la célérité qui est la vitesse de la lumière dans le vide d'environ 300 000 km/s.
L'énergie libérée lors d'une réaction nucléaire est bien plus importante que celle impliquée lors d'une réaction chimique. Par exemple, la fusion d'un proton et d'un neutron pour former un noyau de deutérium libère 3,36×10-13 J ; alors que la combustion de l'hydrogène et de l'oxygène ne libère que 4,75×10-19 J par molécule d'eau, soit environ 700 000 fois moins d'énergie.
| Image | Le cours | Les compléments |
|---|---|---|
 |
Théorie (prof.) |
Energie d'activation (animation, swf) Enthalpie, exo, endo (animation, swf) |
Thermochimie (OS)
La thermochimie est une partie de la chimie qui étudie les phénomènes thermiques qui accompagnent les réactions chimiques. Certaines réactions peuvent dégager de la chaleur, elles sont exothermiques et d’autres en absorbent, elles sont endothermiques. Marcellin Berthelot est considéré comme le fondateur de la thermochimie. Il créa la bombe calorimétrique et participa au perfectionnement du calorimètre. La bombe calorimétrique, qui est une très grande invention, permet de mesurer le pouvoir calorifique d’un combustible; la capacité d’un combustible à produire de l’énergie. Mise au point en 1881, elle est encore en usage aujourd’hui. Au cours du xxe siècle, la thermochimie s’est beaucoup développée. L’application du second principe de la thermodynamique aux systèmes chimiques a permis de prévoir le sens des réactions, le positionnement des équilibres chimiques et donc de définir le rendement et la composition du système après réaction.
| Image | Le cours | Les compléments |
|---|---|---|
 |
Energie et liaisons (animation, mov) Chaleur (vidéo) Calorimétrie (vidéo) La loi de Hess (vidéo-anglais) Les lois de la thermodynamique (vidéo) Principe "zéro" de la thermodynamique (vidéo) |
Electrolyse (OS)
L'électrolyse est une méthode qui permet de réaliser des réactions chimiques grâce à une activation électrique. C'est le processus de conversion de l'énergie électrique en énergie chimique. Elle permet par ailleurs, dans l'industrie chimique, la séparation d'éléments ou la synthèse de composés chimiques. La première électrolyse par courant continu (électrolyse de l'eau) a été réalisée le 2 mai 1800 par deux chimistes britanniques, William Nicholson (1753-1815) et Sir Anthony Carlisle (1768-1842), quelques jours après l'invention de la première pile électrique (publication soumise le 20 mars 1800 dans une lettre en français au président de la Royal Society, Joseph Banks) par Alessandro Volta. Par ailleurs, onze ans auparavant J. R. Deiman et A. Paets van Troostwijk avaient déjà réalisé une électrolyse de l'eau au moyen d'une machine électrostatique et d'une bouteille de Leyde sans réussir à interpréter la réaction observée.
| Image | Le cours | Les compléments |
|---|---|---|
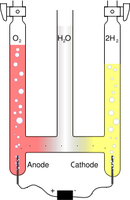 |
Voltamètre d'Hoffmann (Wikipédia) |
Cinétique et équilibre (2 OS - 3 OS)
« Lorsque les modifications extérieures apportées à un système physico-chimique en équilibre provoquent une évolution vers un nouvel état d'équilibre, l'évolution s'oppose aux perturbations qui l'ont engendrée et en modère l'effet. »
| Image | Le cours | Les compléments |
|---|---|---|
 |
Le Châtelier (animation, swf) |
Chimie organique (DF)
La première définition de la chimie « organique » par Nicolas Lémery dans son Cours de chymie publié en 1690, était due à la conception erronée selon laquelle les composés organiques seraient les seuls entrant en jeu dans les processus du vivant. Cependant, les molécules organiques peuvent être produites par des processus sans rapport avec le vivant et le vivant dépend aussi de la chimie inorganique. Par exemple, de nombreuses enzymes n'existeraient pas sans des métaux de transition comme le fer ou le cuivre ; et des matériaux comme les coquillages, les dents ou les os sont constitués en partie de composés organiques et en partie de composés inorganiques.
| Image | Le cours | Les compléments |
|---|---|---|
 |
Théorie HC 1-5 (prof.) |
La chimie organique au quotidien (lecture) Les groupes fonctionnels (film) C'est pas sorcier "le pétrole" (film) C'est pas sorcier "la chimie verte" (film) C'est pas sorcier "les gaz" (film) Nomenclature organique simple (vidéo) |
Les gaz (OC)
| Image | Le cours | Les compléments |
|---|---|---|
 |
Théorie Exercices Solutions |
Lois des gaz parfaits (animation, swf) |
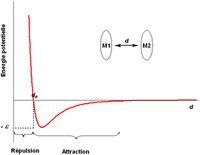
Forces intermoléculaires (OC)
Les forces intermoléculaires correspondent à des interactions entre molécules à courtes distances (0.3-0.8 nm) qui ne modifient pas la nature des molécules, mais qui produisent, en moyenne, une force totale d'attraction intermoléculaire responsable de la cohésion de la matière dans les milieux condensés. A très courte distance (< 0.3 nm), ces interactions deviennent répulsives et elles empêchent les molécules de se rassembler pour atteindre des densités atteignant celles des noyaux. Il existe donc une distance optimale de qui correspond au maximum d'attraction entre deux molécules M1 et M2.
Par exemple, les forces de dispersion de London sont des forces faibles intermoléculaires créées par des dipôles induits. Elles représentent en général la composante la plus importante des forces de Van der Waals. Elles tirent leur nom du physicien germano-américain Fritz London qui formula mathématiquement ces forces pour deux molécules identiques en 1937.
Les forces de London existent du fait que la densité électronique des molécules est probabiliste : il y a une forte chance à tout moment pour que celle-ci ne soit pas équitablement répartie à travers la molécule, ce qui crée un léger moment dipolaire. Les moments dipolaires vont varier très rapidement au cours du temps. Ainsi à chaque distribution inhomogène se crée un moment dipolaire induit qui peut interagir avec les moments dipolaires induits des molécules voisines et une force s'exerce entre les molécules. Naturellement, ces dipôles induits peuvent également réagir avec un dipôle permanent (molécule polaire) mais les forces qui en résultent prennent alors le nom de forces de Debye. L'effet apparaît également dans les molécules polaires, mais c'est alors les forces de Keesom qui prennent le dessus le plus souvent et les forces de London jouent alors un rôle souvent minime dans les interactions entre dipôles permanents.
De manière générale, pour des molécules polaires, les forces de London sont très faibles devant les autres forces intermoléculaires, par exemple les interactions ioniques ou les liaisons hydrogène ou les forces de Keesom entre dipôles permanents. Néanmoins, pour des molécules neutres (comme l'hélium), les forces de London sont la seule force attractive intermoléculaire à grande distance. Elles sont aussi prépondérantes dans les forces d'attraction entre molécules non polaires comme le diazote ou le méthane ou même les gaz rares. Sans l'effet des forces de London, il serait impossible de liquéfier ces gaz.
| Image | Le cours | Les compléments |
|---|---|---|
 |
Théorie Exercices Solutions |
La polarité des molécules (animation) Les moments de dipôle (animation) |
Laboratoires (DF/OS)
⇒ Indications et pictogrammes de danger des laboratoires de 2DF et 2OS
⇒ Protocoles de laboratoire 2DF (protocoles officiels)
⇒ Protocoles de laboratoire 2OS (protocoles officiels)
| Ref. | Titre | Fichiers |
|---|---|---|
| Matériel de laboratoire (photos, UNIGE), verrerie (film) | ||
| 11.2 | Décomposition thermique | Protocole |
| SIS.2.2 | Dosage conductimétrique | Protocole |
| SIS.2.3 | Volumétrie ox-red (eau de javel) | Protocole |
| SIS.2.4 | Volumétrie (synthèse HCl) | Protocole |
| SIS.2.5 | Calcimétrie | Protocole |
| SIS.2.6 | Les piles | Protocole |
| SIS.2.8 | Électrolyse du cuivre | Protocole |
| SIS.3.5 | La puissance du déboucheur lavabo | Protocole |
| SIS.2.1 | Réactions d'oxydoréduction | Protocole |
| 14.1 | Identification de la matière organique | Protocole |
| 436 | Synthèse d'arômes | Protocole |
| SIS.410 | Chaleur de neutralisation | Protocole |
| SIS.2.7 | Application de la loi de Hess | Protocole |
Bibliographie
 |  |
|---|---|
| Chimie de base et avancée |